La EMA ha iniciado una revisión continua de una versión de Spikevax adaptada para proporcionar una mejor protección contra variantes específicas del SARS-CoV-2, el virus que causa el COVID-19.
La revisión se refiere a una vacuna bivalente. Esto significa que se dirigirá a dos cepas de SARS-CoV-2, en este caso la cepa original y la variante Omicron que es motivo de preocupación.
La revisión se centrará inicialmente en los datos de los estudios de laboratorio (datos no clínicos) y en los datos sobre la química, la fabricación y los controles (CMC), que se refieren a la fabricación de la vacuna. A medida que la empresa avance en el desarrollo de su vacuna bivalente, la EMA recibirá más datos, incluidos los relativos a la respuesta inmunitaria contra la cepa original y la variante Omicron de interés.
Al iniciar una revisión continua, la EMA podrá evaluar estos datos a medida que estén disponibles. La revisión continuará hasta que haya suficientes datos para una solicitud formal. La EMA comunicará más adelante el resultado de la revisión continua o una eventual solicitud.
La composición de las vacunas COVID-19 adaptadas dependerá, en última instancia, de las recomendaciones de las autoridades de salud pública y de la Organización Mundial de la Salud (OMS), así como de las consideraciones de organismos reguladores como la EMA y otros miembros de la Coalición Internacional de Autoridades Reguladoras de Medicamentos (ICMRA). Estos organismos están colaborando estrechamente para determinar las cepas adecuadas para las vacunas COVID-19 adaptadas.
Este proceso de revisión continua es una de las formas en que las autoridades de la UE están trabajando para garantizar que los Estados miembros de la UE tengan a tiempo DeepL las vacunas adaptadas de COVID-19 que puedan necesitar para combatir las variantes actuales y emergentes de SARS-CoV-2.
Acuerdo con Moderna para adaptar los plazos de entrega |
Más información sobre la vacuna
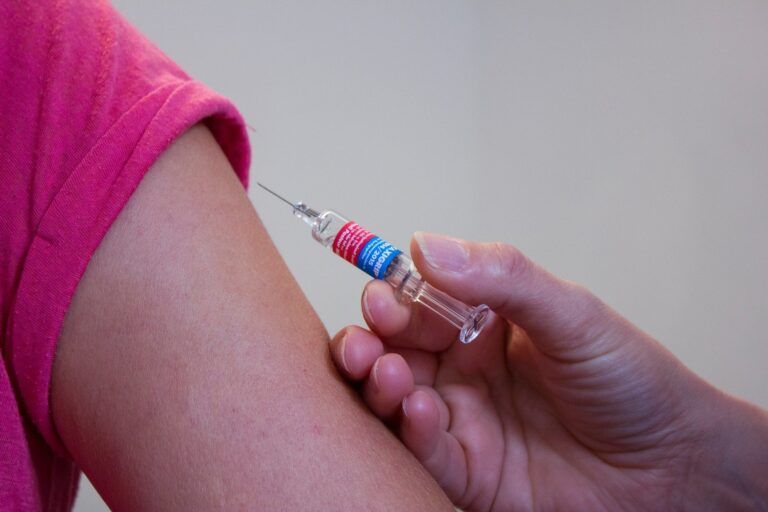
Spikevax actúa preparando al organismo para defenderse de COVID-19. Contiene una molécula llamada ARN mensajero (ARNm) que tiene instrucciones para fabricar la proteína spike. Esta es una proteína de la superficie del SARS-CoV-2 que el virus necesita para entrar en las células del cuerpo.
Cuando una persona recibe la vacuna, algunas de sus células leerán las instrucciones del ARNm y producirán temporalmente la proteína pico. El sistema inmunitario de la persona reconocerá entonces esta proteína como extraña y producirá anticuerpos y activará las células T (glóbulos blancos) para que la ataquen.
Si, más adelante, la persona entra en contacto con el SARS-CoV-2, su sistema inmunitario lo reconocerá y estará preparado para defender al organismo contra él.
El ARNm de la vacuna no permanece en el organismo, sino que se descompone poco después de la vacunación.
Más información sobre el procedimiento
Una revisión continua es una herramienta reguladora que la EMA utiliza para acelerar la evaluación de los datos de un medicamento o vacuna durante una emergencia de salud pública.
Al iniciar esta revisión continua para Spikevax, el Comité de Medicamentos de Uso Humano (CHMP) de la EMA podrá revisar los datos de los estudios en curso a medida que estén disponibles. Por tanto, el CHMP estará en condiciones de emitir un dictamen poco después de que la empresa presente una solicitud.

COVID-19 vaccine effectiveness in adolescents aged 12–17 years and interim public health considerations for administration of a booster dose |




Deja una respuesta